近几年,为加快具有临床价值的新药和临床急需的仿制药研发上市,国家局打出了一系列组合拳。新《药品注册管理办法》以专章形式规定了药品加快上市注册程序,设立了突破性治疗药物、附条件批准、优先审评审批及特别审批四条加速通道。其中,优先审评审批起到了非常重要的作用。
一、优先审评趋势全览
截止2021年3月26日,纳入优先审评的药品受理数达1247个(其中15个未公布受理号)。这其中仿制药申报占比最多,为41%,其次为进口药,约有三分之一的占比,新药占比24%。
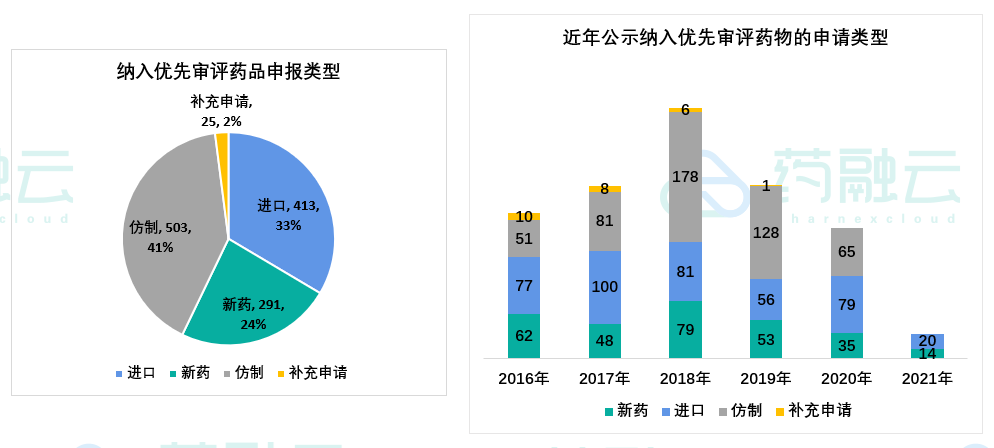
根据纳入药品优先审评的公示时间来统计,自国家实行优先审评审批以来,创新药的申报从2017年到2018年快速增加, 2019年有所下降。快速上升与国家政策有关,因2016年优先审评审批政策刚开放时,对企业的吸引力大,加上当时中国在重大疾病领域存在药品空白,急需一批新药来弥补空白。与此同时,中国为了缩短国外新药在中国上市的时间,宣布接受境外临床试验数据,极大提高新药在华的上市效率。受益于该项政策,一批原研药被纳入优先审评审批队列,因此出现2017年的进口药高峰期。自2018年以来,仿制药的数量逐渐减少,优先审评资源正更多地向具有明显临床价值、临床急需和临床优势的药品聚焦。
二、企业优先审评排行榜,东阳光居榜首
已纳入优先审评的1247个受理号中,涉及企业275家,获得优先审评受理品种数量最多的5家企业分别是东阳光、恒瑞、中国生物制药、华海、齐鲁。具体申报情况如下:
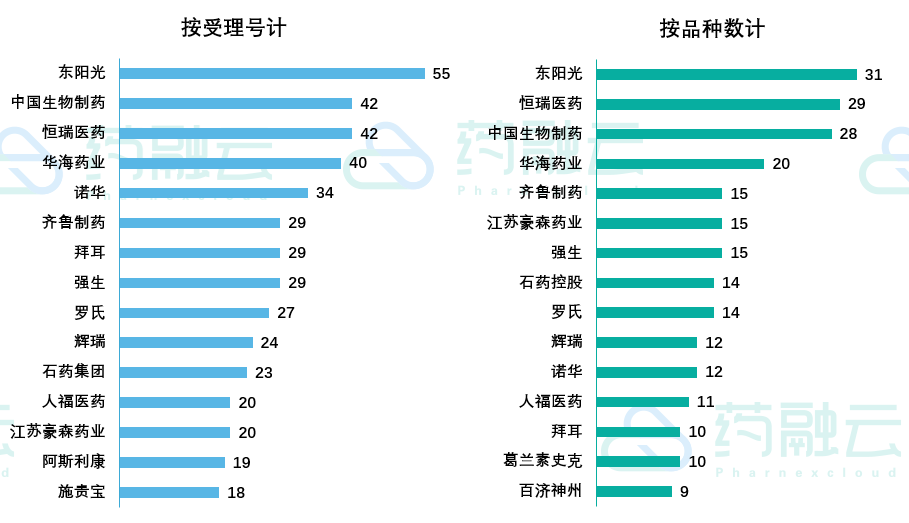
申报受理号数量上,东阳光受理数量最多,达55个,其次为中国生物制药及恒瑞医药。作为国内新药产出较多的企业,这三家企业纳入优先审评的药品数量情况,一定程度也能窥见其创新力所受认可度。
三、”儿童用药“为起点,现如今“明显治疗优势”成最热产品
对于纳入名单中1247个受理号的纳入理由我们也进行了统计,如下图所示:
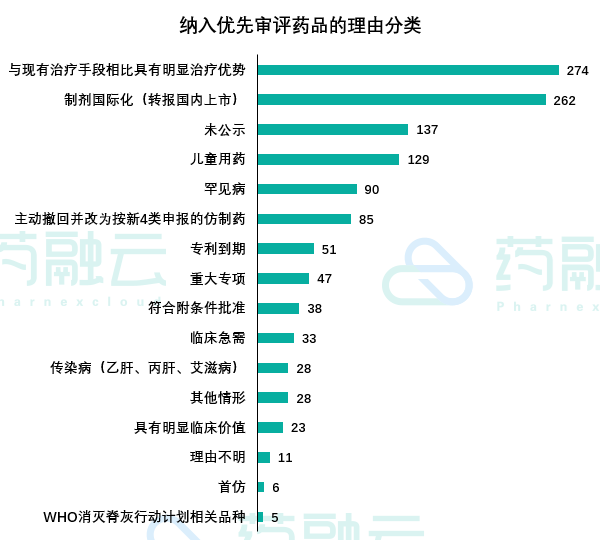
经统计,目前被纳入优先审评最多的理由是“与现有治疗手段相比具有明显治疗优势”,共涉及274个药品,占21.97%。以此理由纳入优先审评的药品以外资药企申请的进口药品居多,占到61%。其次,有262个药品以“制剂国际化品种(转报国内上市)”纳入优先审评,占21%。“儿童用药”是CDE建立实施优先审评制度的起点,最早一批公示的优先审评药品就属于儿童药。目前共有129个儿童药获得优先审评,从数量上看,并不算多,主要还是儿童用药的开发存在多方面的障碍,企业积极性还是不高。
从获批生产的情况来看,以“与现有治疗手段相比具有明显治疗优势”为由优先审评的品种最多。目前已有103个此类药物在中国获批上市,而获批的此类药物中,进口药占比高达77%(按受理号计)。
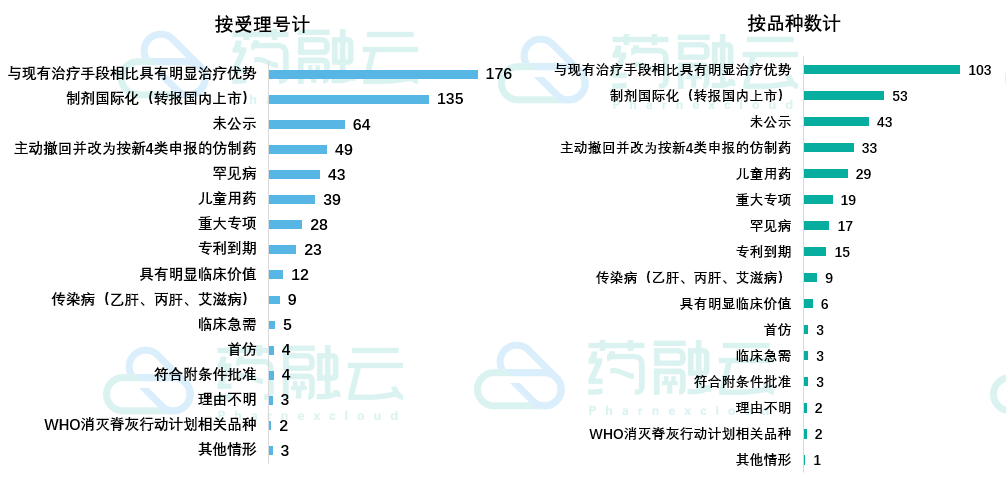
以下是已获批的“与现有治疗手段相比具有明显治疗优势”的1类药物信息:
恒瑞医药有3款,分别是:注射用甲苯磺酸瑞马唑仑、氟唑帕利胶囊、注射用卡瑞利珠单抗。


无疑,根据国家相关政策,药品纳入优先审评序列,意味着药品上市的审评审批时间将缩短,进而加速药品的上市,福利相关患者,同时也有利于企业抢占市场。













































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论