
2023年7月19日,Catalyst Pharmaceuticals宣布从Santhera Pharmaceuticals获得Vamorolone的北美独家许可。Vamorolone可能是治疗Duchenne型肌营养不良症(杜氏肌营养不良,DMD)的最有前途的抗炎类固醇新药。

2023年4月25日,中国国家药品监督管理局药品审评中心(CDE)受理品种信息显示,Santhera Pharmaceuticals和曙方医药(Sperogenix)联合提交了治疗杜氏肌营养不良(DMD)新药vamorolone口服混悬液的临床试验申请。

早在2022年1月4日,曙方医药与Santhera制药宣布就vamorolone达成独家授权协议,曙方医药获得vamorolone在大中华区(包括中国内地、香港特别行政区、澳门特别行政区和中国台湾)用于杜氏肌营养不良及其他罕见病适应症的独家开发和商业化权益。

截止2023年10月10日收盘,公司市值13.76亿美元,约合100.39亿人民币。
公司信息
获得Vamorolone北美独家许可的Catalyst Pharmaceuticals是一家专注于开发和商业化罕见病药物的公司。
药融云数据www.pharnexcloud.com显示:该公司成立于2002年,2006年IPO登陆纳斯达克,前称Catalyst Pharmaceutical Partners,于2015年改为Catalyst Pharmaceuticals(中文名:催化剂制药),总部位于美国佛罗里达州。Catalyst Pharmaceuticals在发展现有管线的基础上,还通过收购罕见病和中枢神经系统治疗类别的早期或后期产品或公司技术平台来扩大和多样化其产品组合。当前在美国的旗舰商业产品是FIRDAPSE(Amifampridine)10 mg片剂,2023年1月,获得了FYCOMPA(Perampanel)CIII的美国商业权利。
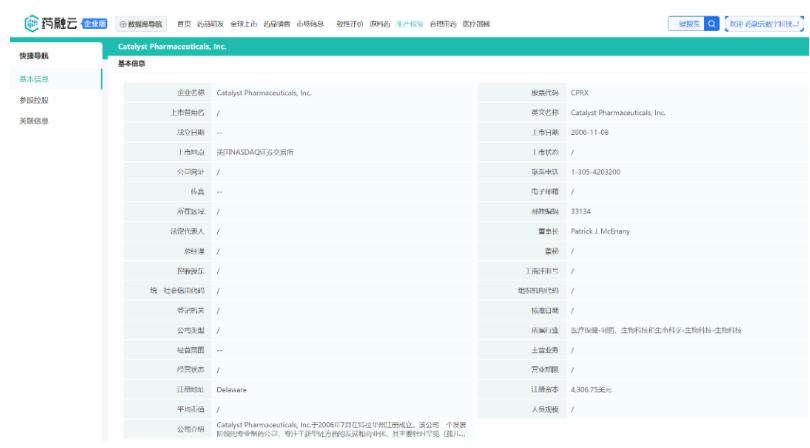
药融云数据库:公司信息
Catalyst Pharmaceuticals于2021年3月实施了一项股票回购计划,从公开市场购买最多4000万美元的股票。截至2022年12月31日,该公司已在公开市场上回购了约320万股Catalyst Pharmaceuticals普通股,平均价格为每股5.92美元,总购买价约为1900万美元,剩余约2100万美元用于该计划下的未来购买。
精准的在研管线
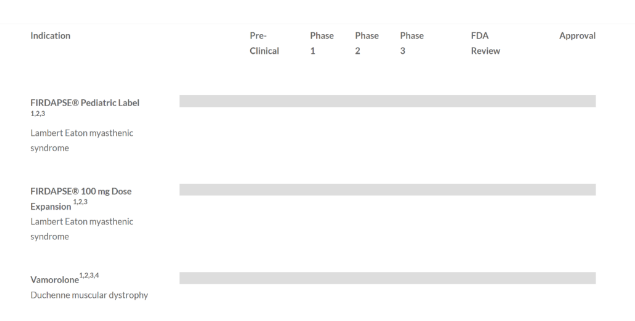
以患者为中心,Catalyst Pharmaceuticals致力于开发和商业化创新的一流药物,治疗罕见的神经和癫痫疾病。Catalyst Pharmaceuticals当前研发管线只有三个产品,正如前面所提到的,其中一个还是今年七月份才从Santhera Pharmaceuticals获得。各管线具体情况如下:
FIRDAPSE (amifampridine)
FIRDAPSE(Amifampridine)片剂(10 mg)是一种口服、非特异性、电压依赖性钾(K+)通道阻滞剂,可引起突触前膜去极化并减缓或抑制复极化。该作用导致慢电压依赖性钙(Ca2+)通道的开放,允许随后的Ca2+内流。反过来,它诱导含有乙酰胆碱(ACh)的突触囊泡的胞吐作用,以释放更多的ACh进入突触间隙,增强神经肌肉传递并提供改善的肌肉功能。
Amifampridine药物基本信息
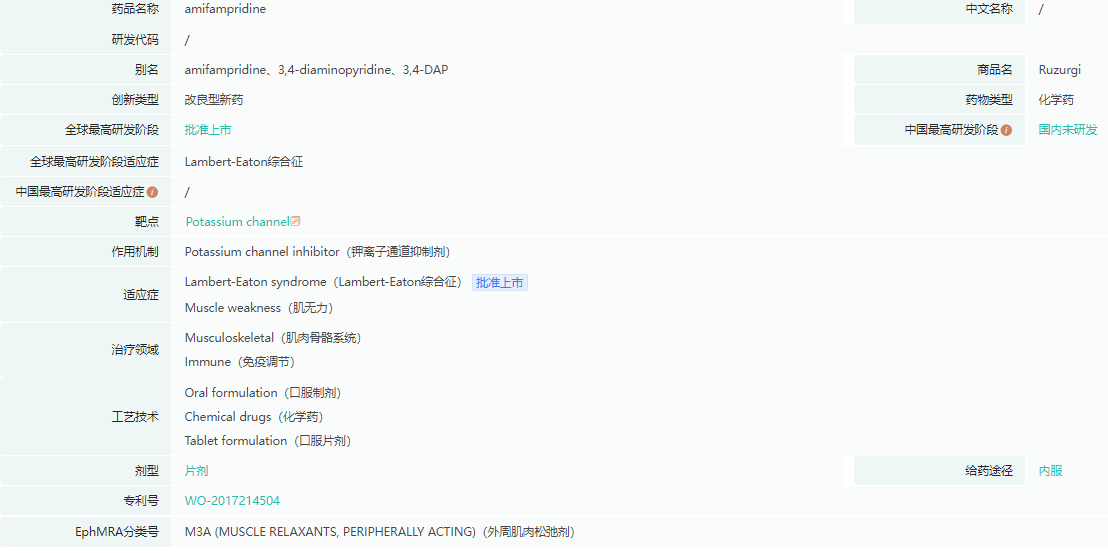
截图来源:药融云全球药物研发数据库
2018年3月,Catalyst Pharmaceuticals提交了一份NDA,寻求批准FIRDAPSE用于治疗LEMS的申请。该NDA于2018年5月被接受备案,2018年11月28日,FDA批准FIRDAPSE片剂用于治疗兰伯特-伊顿肌无力综合征(LEMS)成年患者(17岁及以上),Catalyst Pharmaceuticals于2019年1月在美国推出了FIRDAPSE。此外,2022年9月29日,FDA批准了补充新药申请(sNDA),将FIRDAPSE片剂(10毫克)的指定年龄范围扩大到包括6岁及以上的儿科LEMS患者。
FYCOMPA(perampanel,吡仑帕奈)
FYCOMPA是一种处方药,已在全球60多个国家获得批准,作为12岁及以上癫痫患者伴有或不伴有继发性全身性癫痫发作的部分发作的辅助治疗药物。此外,FYCOMPA已在超过55个国家获得批准,作为12岁及以上癫痫患者原发性全身强直-阵挛发作的辅助治疗。在美国,FYCOMPA也适用于4岁及以上癫痫患者的部分发作性癫痫发作(伴或不伴继发性全身性癫痫发作)的单药治疗和辅助治疗。以2 mg、4 mg、6 mg、8 mg、10 mg和12 mg薄膜衣片以及0.5 mg/mL口服混悬剂的形式提供。FYCOMPA已被美国缉毒署指定为联邦管制药物(CIII)。
口服药物FYCOMPA是一种选择性非竞争性AMPA(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸)受体拮抗剂,AMPA受体是离子型谷氨酸受体的主要亚型,谷氨酸是介导癫痫发作的主要神经递质。作为AMPA受体拮抗剂,Fycompa能通过靶向突触后AMPA受体-谷氨酸的活动,减少与癫痫发作相关神经元的过度兴奋。这是美国FDA批准的第一个以这种方式起作用的抗癫痫药物。
2012年10月FDA批准FYCOMPA辅助治疗12岁及以上癫痫患者的部分发作癫痫(伴或不伴继发性全身性癫痫发作)。2015年6月,FDA批准扩大FYCOMPA的适应症范围,用于辅助治疗12岁及以上癫痫患者的原发性全身强直-阵挛(PGTC)发作。
总结
Catalyst pharmaceuticals的目标是开发和商业化针对罕见神经肌肉和神经疾病和疾病的新处方药。致力于对那些患有罕见疾病的人的生活产生有意义的影响。基于当前形势,Catalyst pharmaceuticals制定了未来的发展战略,主要包括:(1)继续将FIRDAPSE商业化用于治疗LEMS并提高疾病意识。(2)开始将FYCOMPA商业化。(3)在日本和亚洲其他地区寻求FIRDAPSE的批准。(4)寻求购买其他产品。当前Catalyst pharmaceuticals通过收购罕见病和中枢神经系统治疗类别的早期或后期产品或公司或技术平台来扩大和多样化其产品组合。为了实现这些优先事项,Catalyst pharmaceuticals将继续采用严格的方法来评估资产,相信这种战略扩张将更好地定位公司,以建立更广泛更多样化的候选药物组合,这将在短期和长期内为公司增加更大的价值。
参考:
NMPA/CDE;
FDA/EMA/PMDA;
NMPA/CDE
药融云数据,www.pharnexcloud.com
FDA/EMA/PMDA;
相关公司公开披露(除标注外,正文图片均来自企业官网);
https://catalystpharma.com/;
https://www.eisai.com/news/news201543.html;等等。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论