引言:2021年初,国家局发布了《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》,其对灭菌工艺研究的要求是比较高的。从指导原则中的描述,以及近年来的审评尺度,有几点是特别需要注意的:
一、对于热稳定性好的品种,选择121℃、12min的灭菌条件就可以了,不要求达到121℃、15min。
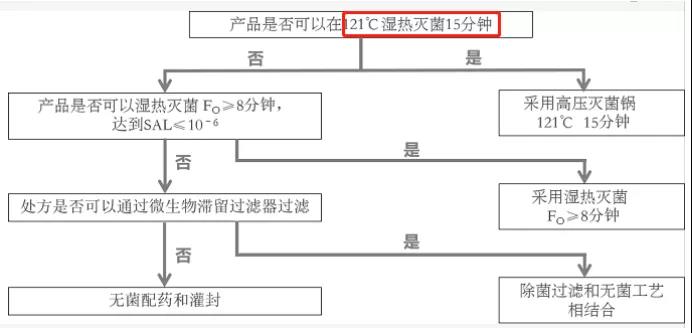
在2007年CDE的电子刊物中,介绍了欧盟灭菌决策树,其首选的灭菌条件是121℃、15min。
而在2021年的指南的灭菌决策树中,首选的灭菌条件已经悄然变成了F0≥12,即达到121℃、12min的条件即可。
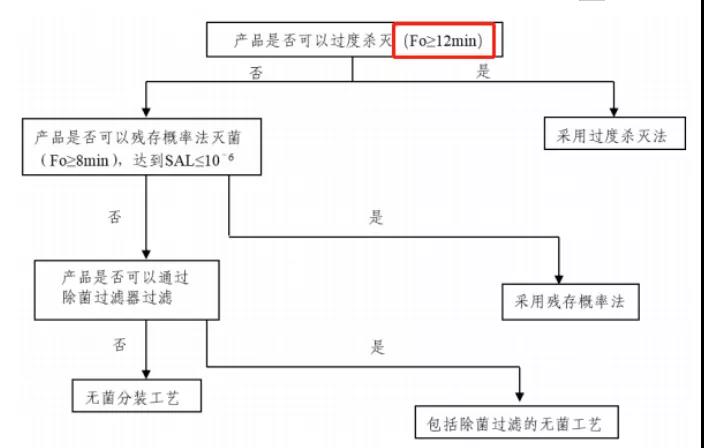
事实上,121℃,15min是欧盟推荐的灭菌条件,采用该方式灭菌的产品申报时可以不提交灭菌验证资料,理由应该就是其对无菌保证有着极高的保险系数。在一些技术指南中,121℃,15min又叫做半周期法。这种方法是在灭菌柜冷点的位置放置了初始细菌计数为106 CFU的生物指示剂,其灭菌时间是所有生物指示剂死亡时间的两倍。在半周期法中,灭菌时间为14min至16min。初始细菌计数为106 CFU的生物指示剂的存活概率在7 min时为10%,在8 min时为1%,因此(7 min至8min)×2=14min至16min。
在国内的法规颁布时,CDE的专家应是参考了国外的法规和技术指南,结合国内的实际情况,对灭菌决策树进行了相应的修订。在这种要求下,我们在进行灭菌条件筛选时,可将121℃、12min作为首选。特别是对一些热稳定性并不是特别好的品种,缩短几分钟的灭菌时间也可以提高产品的稳定性。
二、即便参比制剂选择了无菌生产工艺,自制品也应进行灭菌工艺筛选,也可能需要选择终端灭菌工艺。
最典型的例子是奥沙利铂冻干粉针剂被排除出参比制剂目录,要求改为终端灭菌的水针剂进行申报。此外,尚有多个非终端灭菌的参比制剂,被要求进行灭菌工艺的研究。特别要注意的是,某些品种CDE已经受理了过度杀灭工艺,那么就不会批准无菌工艺,甚至是残存概率法也会被要求重新研究。
由于各国法规的不同,日本上市的参比制剂,特别是输液产品的参比制剂要特别注意,其往往采用了F0<8的终端热处理工艺,这在国内是不被认可的,势必要更改为终端灭菌工艺。那么如何处理终端灭菌工艺造成的降解以及和参比制剂的质量差异,将非常关键。
三、注重灭菌验证过程中的数据分析
这次颁布的指南原文中写道:
在物理确认试验中,应确认关键和重要的操作参数并有相应的文件和记录。通常需要关注的主要参数包括
- 每个探头所测得温度的变化范围
- 不同探头之间测得的温度变化范围
- 探头测得的温度与设定温度之间的差值
- 探头测得超过设定温度的最短及最长时间
- F0 的下限及上限
- 灭菌阶段结束时的最低F0值
- 灭菌阶段的最低和最高压力
- 饱和蒸汽温度和压力之间的关系
- 灭菌阶段腔室的最低和最高温度
- 热穿透温度探头之间的最大温差或F0 的变化范围
- 热分布试验中温度探头间的最大温差
- 最长平衡时间
- 最少正常运行的探头数
合格标准应结合灭菌条件、灭菌设备的特点以及产品的实际情况制定。通常情况下,灭菌柜腔室最冷、最热点和平均温度之间的温差应不超过2.5℃。保温时间内温度波动应在±1.0℃之内,如果温度差别过大,提示灭菌柜的性能不符合要求,需要寻找原因并进行改进,重新进行验证。另外对于热敏感的药物,还应该控制灭菌柜的升温和降温时间,以保证热能的输入控制在合理的范围以内,不会对产品的热稳定性造成影响。
法规写得非常简略,很多参数虽然列出来了,但是如何评估并没有详细解释。至于“最冷、最热点和平均温度之间的温差应不超过2.5℃。保温时间内温度波动应在±1.0℃之内”,都只是列举验证的最低标准,只是这样还远不能达到要求。对设备的具体要求,还是要根据产品的特点而定。
根据以上几点的分析,我们发现国内对灭菌条件的选择还是非常严格的。在进行注射剂一致性评价的工作中,很多时候我们要选择比参比制剂更加剧烈的灭菌条件。那么既要达到法规终端灭菌的要求,又要保证灭菌过程及灭菌后产品的稳定性,那么,一个性能优良的灭菌设备就是必须的。
在评价灭菌设备时,或者说进行性能验证时,我尝试列举几个关键点提请各位同仁关注:
1. 缩短灭菌柜平衡时间(升温时间)
平衡时间是指腔室达到最低设定灭菌温度和装载达到最低设定灭菌温度之间的时间间隔。这个时间表示去除空气和升温使装载达到适当灭菌条件的能力。即使最终达到了设定的灭菌温度,平衡时间的延长也表示去除空气或加热能力的不足,对热敏感品种产生的影响不容忽视。

欲想缩短平衡时间,需要保证:
(1)动力能源供应充足,可使灭菌柜内温度快速稳定地达到规定的灭菌温度。
(2)热分布均匀。若灭菌柜中冷点明显,则会造成升温时灭菌其他点位温度都达到121℃后,冷点处还在119℃,120℃徘徊几分钟,造成灭菌时产品实际承受高温的时间延长。
(3)灭菌程序的设定。一般升温程序都会在初始快速升温,在上升到较高温度时会减小进气量,慢速升温到121℃(或其他设定的灭菌温度)。优质的灭菌柜由于其构造设计合理,即使用较快的速度将温度提升,也不至于造成某些位置的温度失控。而性能较差的灭菌柜,往往在程序设计上降低升温速度,掩饰其热分布不够均匀的缺陷。
为了明确何为优质灭菌柜,我们可以设定两个指标,用于设备采购URS或设备验证指标(以下均指小容量注射剂灭菌柜,大输液灭菌柜指标可适当放宽):
A. 合格的灭菌柜从常温升到121℃开启灭菌的时间可以控制在15min以内,优质的灭菌柜升温时间甚至可以控制在10min左右。
B. 合格的灭菌柜热分布(穿透)验证时平均F0值与冷点的F0值之差不超过3.5,优质的灭菌柜差值不超过2.5。
2. 缩短灭菌柜降温时间
同理,灭菌柜的降温时间也很重要。一般灭菌柜的降温时间速度比升温快得多。由于大多数药物在温度超过100℃后才会在短时间内产生降解。因此,可以设定合格灭菌柜从121℃降至100℃以下的时间<5min,优质灭菌柜从121℃降至100℃以下的时间<3min。
3. 减小柜内实际温度与设定温度的偏差
灭菌率是指某一温度T(℃)下灭菌1min所获取的标准灭菌时间(121℃下的灭菌时间)。L(T,Z)=10(T-Tref)/Z ,Tref指标准灭菌温度(121℃)。例如:在Z=10℃的指示系统,温度120℃灭菌1min,计算灭菌率L=0.79,相当于121℃下灭菌0.79min。温度122℃灭菌1min,计算灭菌率L=1.26,相当于121℃下灭菌1.26min。如果灭菌段的实际平均灭菌温度为122℃,则灭菌段累计F0值约为15.12。同理,可计算110℃持续1min,F0值为0.08;115℃持续1min,F0值为0.25,据此可大致推算升降温段的累计F0应不超过3-4。
据此,可设定灭菌柜的两个指标(以121℃、12min灭菌条件为例):
A. 合格的灭菌柜整个灭菌过程的平均F0值应不超过20,优质灭菌柜的F0值在15左右。
B. 合格的灭菌柜整个灭菌过程的灭菌段平均温度在122℃以下,优质灭菌柜灭菌段平均温度在121.5℃以下。
应当说明的是,以上评价灭菌柜的指标只是参考国内一般设备制造水平和大部分注射剂的质量要求。正如指导原则中所说“合格标准应结合灭菌条件、灭菌设备的特点以及产品的实际情况制定。”我们只有对自己要研制的品种和使用的设备有了充分的理解,才能有针对性地对设备提出恰当的要求,选择适宜的灭菌条件,真正践行“产品是设计出来的”这一理念。














































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论